Künstliche Intelligenz im Gesundheitswesen: Biotech oder Tech-Bio
Die immer breiteren und konkreten Anwendungen von Technologien der künstlichen Intelligenz hat weitreichende Auswirkungen insbesondere auf den Gesundheitsmarkt. Dies ist bereits bei vielen Health-Tech-Projekten und insbesondere im Bereich der Radiologie zu beobachten. Exemplarisch für die Dynamik sei hier nur angeführt, dass in den USA allein in diesem Bereich bereits hunderte von Algorithmen für die kommerzielle Nutzung zugelassen sind. Unter dem Begriff Tech-Bio (im Gegensatz zu Biotech) versuchen neue, auf KI fokussierte Unternehmen, die Märkte für Arzneimittelentwicklung und Gesundheitsdienstleistungen zu revolutionieren. Eine allmähliche Konvergenz von Biotech und Tech-Bio ist im Gange und wird sich in den kommenden Jahren fortsetzen. Wir sind davon überzeugt, dass sich daraus zahlreiche attraktive Anlagemöglichkeiten ergeben werden. Anleger, die diese Chance nutzen wollen, sollten sich jedoch darüber im Klaren sein, wo wir uns im Entwicklungszyklus der Technologie befinden, welche Geschäftsmodelle sich wahrscheinlich durchsetzen werden und wo die derzeitigen Grenzen beim Einsatz von KI im Gesundheitswesen liegen.
Die jüngsten Entwicklungen beim Einsatz von Lösungen der künstlichen Intelligenz im Gesundheitssektor verändern fast alle Bereiche der Branche, von der Identifizierung, dem Entwurf und der Entwicklung neuer Therapeutika bis hin zur Diagnostik oder der Bereitstellung und dem Management fast aller Dienstleistungen und Produkte auf dem Gesundheitsmarkt.
KI in der Arzneimittelforschung.
Computergestützte Methoden werden schon seit einiger Zeit in der Arzneimittelentwicklung eingesetzt:
- In den frühen 1980er Jahren galt das Computer Aided Drug Design („CADD1„) als Revolution, da es die Erstellung virtueller Modelle von Arzneimittelmolekülen und ihren Zielmolekülen2 ermöglichte, um zu sehen, wie gut sie sich verbinden könnten.
- In den 1990er Jahren wurden Methoden der quantitativen Struktur-Wirkungs-Beziehung (quantitative structure activity relationship „QSAR3 eingeführt, um Beziehungen zwischen biologischen Aktivitäten und den strukturellen Eigenschaften chemischer Verbindungen aufzuzeigen.
- Die Entwicklungen beschleunigten sich in den 2010er Jahren, als die breitere Anwendung von Deep-Learning-Techniken einen echten Nutzen zeigte, wie bei der QSAR-Challenge des Pharmariesen Merck im Jahr 20134 oder beim Wettbewerb „Critical Assessment for Structure Prediction“ im Jahr 20185, als das AlphaFold-Team von Deepmind unter Verwendung tiefer neuronaler Netze die Form von 25 der 43 komplexesten Proteine auf der Grundlage ihrer DNA vorhersagen konnte, indem es das Modell anhand einer Reihe bekannter Proteine trainierte.
- Eine weitere bemerkenswerte Entwicklung war die Freigabe von AlphaFold2 für die öffentliche Nutzung im Jahr 2022, die eine Beschleunigung des Einsatzes fortschrittlicher KI-Tools in der biologischen Grundlagen- und Anwendungsforschung auslöste.
Infolge der breiteren Anwendung von KI-Tools in fast allen Aspekten des Arzneimittelentwicklungsprozesses wurden nach Angaben der FDA (der US-amerikanischen Aufsichtsbehörde für Pharmazeutika und Gesundheit) im Jahr 2021 mehr als 100 neue Arzneimittel und biologische Präparate eingereicht, bei denen Komponenten der KI bzw. des maschinellen Lernens zum Einsatz kamen.6
Laut einer Studie von Alacrita3 könnte der Beitrag der KI zur Arzneimittelforschung in mehrfacher Hinsicht vielversprechend sein:
- Identifizierung von Zielmolekülen: Die Identifizierung von Molekülen (z. B. menschliche Proteine oder Gene) oder Signalwegen im menschlichen Körper, die von einer Krankheit betroffen sind und mit Hilfe von Arzneimitteln beeinflusst werden können, erfordert die Verwaltung großer Mengen biomedizinischer Patientendaten sowie Daten aus der Grundlagenforschung.
- Vorhersage von Proteinstrukturen: Dreidimensionale Proteinstrukturen sind entscheidend, um zu verstehen, wie sich ein vielversprechendes potenzielles Medikament an das Zielprotein binden kann. Trotz der durch Alphafold2 erzielten Fortschritte bleibt die Vorhersage von Proteinliganden aufgrund ihrer Komplexität eine große Herausforderung.
- Virtuelles Screening: Die jüngste Entwicklung chemischer Datenbanken, die Milliarden von Molekülen oder chemischen Partikeln (potenzielle neue Arzneimittel) enthalten, stellt eine Chance dar. Allerdings bedarf es hierfür effizientere und effektivere virtuelle Screening-Methoden. Mit herkömmlichen Methoden kann es sehr lange dauern, bis ein Leitwirkstoff mit geeigneten Eigenschaften für die klinische Entwicklung identifiziert ist.
- Chemische und funktionelle Eigenschaften: Es ist wichtig zu verstehen, wie der Körper ein Medikament aufnimmt, verteilt, verstoffwechselt und ausscheidet. Wie bereits angedeutet, wurde mit Hilfe von tiefen neuronalen Netzen, die auf QSAR angewandt werden, beachtliche Fortschritte erzielt. Es sind jedoch noch weitere Anstrengungen erforderlich, um anormale Ergebnisse für verschiedene Proteinfamilien vorherzusagen.
- De novo design: Im Gegensatz zu dem Screening bereits vorhandener Wirkstoff-Datenbanken ist das KI-gestützte De novo design ein zwar komplexerer Prozess, der jedoch eine Vielzahl neuer Strukturen hervorbringen kann. Bis September 2023 hat nur ein von Insilico Medicine entwickeltes Medikament die Phase 2 erfolgreich durchlaufen.
- Umwidmung / Umnutzung von Arzneimitteln: Hierbei wird die Fülle von Daten zu einem bereits zugelassenen oder erprobten Arzneimittel genutzt, um es in neue Richtungen umzuwidmen.
Vor diesem vielversprechenden Hintergrund zeigen die jüngsten Rückschläge bei klinischen Studien einiger KI-fokussierter Unternehmen wie BenevolentAI oder Exscentia, dass die Fortschritte, die beim Design und der Synthese von Liganden7 gemacht worden sind, nicht ausreichen. Wir müssen unser Verständnis der Biologie und unser Verständnis über die Generierung von relevanten Daten zur Wirksamkeit und Sicherheit weiter vorantreiben9.
KI in der Pharmabranche.
McKinsey and Co10 hat kürzlich einen Bericht veröffentlicht, in dem bewertet wird, wie Pharmaunternehmen aus der Einführung generativer KI-Lösungen in verschiedenen Aspekten ihres Geschäftsmodells einen zusätzlichen Wert generieren können. Dabei wird geschätzt, dass die Technologie in den folgend aufgelisteten Segmenten zwischen 60 und 110 Mrd. USD an zusätzlicher Wertschöpfung per annum generieren könnten (siehe Schaubild 1):
- Forschung und Früherkennung: Unterstützung bei der Identifizierung von Zielmolekülen, Herausfiltern vielversprechender Ansätze und Unterstützung bei präklinischen Tests zur Bestimmung der Wirksamkeit. Insgesamt schätzt McKinsey, dass die Erfolgswahrscheinlichkeit von Studien um etwa 10 % erhöht und Kosten und Dauer um ca. 20 % reduziert werden können.
- Klinische Studien: Straffung der Prozesse für klinische Studien und Senkung der Kosten um bis zu 50 % durch Verkürzung der für die Durchführung einer Studie erforderlichen Zeit um mehr als 12 Monate und Steigerung des Kapitalwerts des Projekts um mindestens 20 % durch verbesserte Interaktion mit Gesundheitsbehörden, Qualitätskontrolle und verbessertes Signalmanagement.
- Operative Performance: Verbesserung aller Aspekte der betrieblichen Wertschöpfungskette, Beschaffung, Fertigung, Qualitätskontrolle und Lieferketten.
- Commercial Performance: Verbesserung verschiedener Aspekte der Interaktion mit Leistungserbringern, Apothekern, Versicherern und Patienten.
- Medical Affairs: Unterstützung in der Patientenversorgung durch einen vertrauensvollen wissenschaftlichen Austausch zwischen Pharmaunternehmen und Leistungserbringern im Gesundheitswesen.
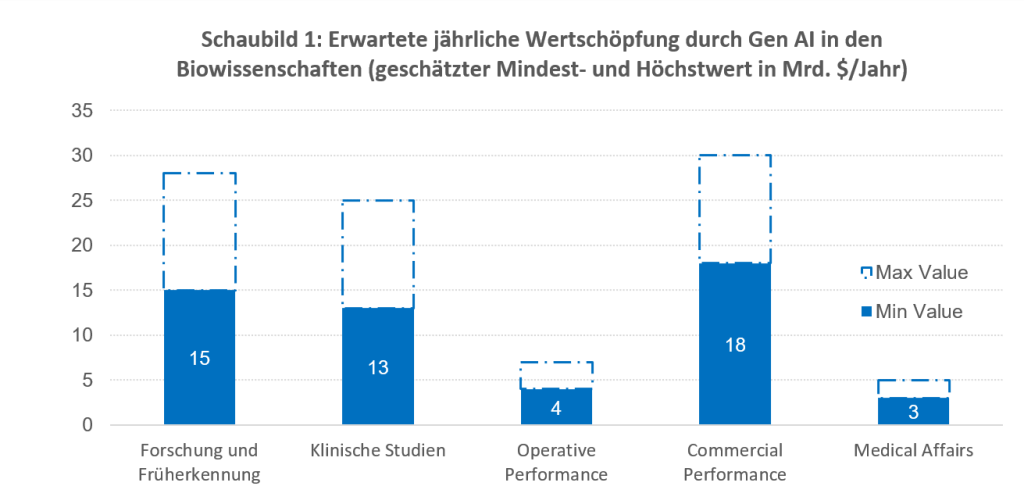
Source: McKinsey and Co
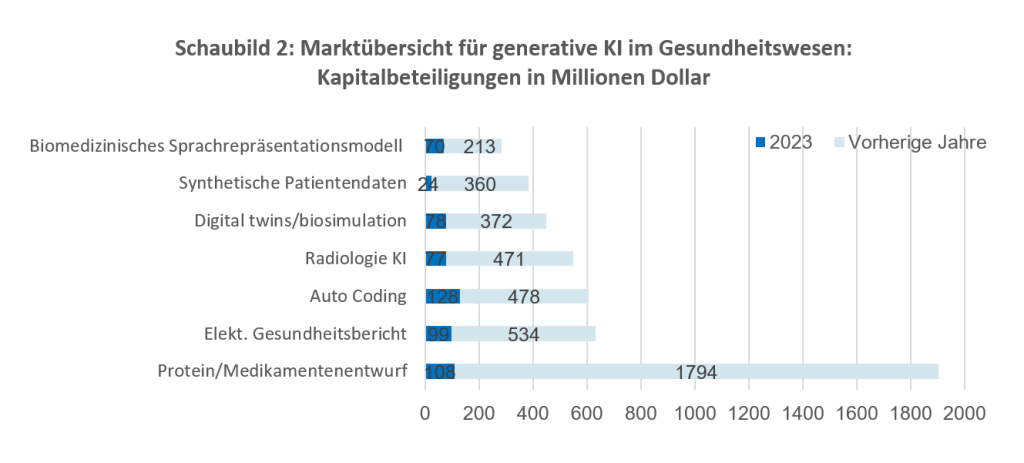
Source: CB insights
Nichtsdestotrotz breitet sich der Einsatz von KI weiter aus und ist vor allem im Bereich medizinischer Geräte in den USA erfolgreich. Im Dezember 2013 berichtete Healthimaging12, dass die FDA bereits 700 KI-Algorithmen für das Gesundheitswesen zugelassen hat, davon mehr als 76 % im Bereich der Radiologie (521), gefolgt von Kardiologie (71), Neurologie (16), Hämatologie (14) und Gastro-Urologie (10).
Aus allen oben genannten Gründen hat KI das Potenzial, die Gesundheitsbranche erheblich und positiv zu beeinflussen. Als Investoren freuen wir uns, dass wir bereits jetzt von den Chancen in diesem Bereich profitieren können. Gleichzeitig sind wir der Ansicht, dass bei neuen Investitionen in Unternehmen, die sich mit KI beschäftigen, einige Überlegungen berücksichtigt werden sollten:
- Viele neue Unternehmen, die sich auf KI-Software für die Biotechbranche spezialisiert haben, werden derzeit gegründet und mit Kapital ausgestattet. Viele dieser Unternehmen gleichen jedoch eher einem Softwareunternehmen als einem Biotechnologie-Start-up (eher Tech-Bio als Biotech). Auch wenn das Ziel das gleiche ist (Veränderung der Biotech- bzw. Gesundheitsmärkte), müssen sich diese Tech-Bio-Unternehmen oft erst das Wissen, die Erfahrung und die Fähigkeiten aneignen, um sich im komplexen Ökosystem der Biowissenschaften zurechtzufinden. Aus diesem Grund ist eine Konvergenz von Tech-Bio und Biotech nicht nur wahrscheinlich, sondern auch notwendig.
- Im Bereich der Therapeutika gibt es immer noch erhebliche Einschränkungen bei der Anwendung von KI-Tools in allen Aspekten des Arzneimittelentwicklungsprozesses. Es ist daher von entscheidender Bedeutung, diese Grenzen zu verstehen und zu wissen, wie neue KI-Tools die Fähigkeit eines Biotech-Teams, neue Produkte schneller auf den Markt zu bringen, effektiv verbessern können.
- Trotz aller Fortschritte ist die Markteinführung eines neuen Medikaments nach wie vor ein kapital- und zeitintensiver Prozess, der ein syndiziertes Zusammenarbeiten von Investoren erfordert. Selbst sehr ehrgeizige und professionell aufgestellte Projekte benötigen eine breite Unterstützung durch eine Vielzahl von Marktteilnehmern.
- KI-Tools und -Datenbanken werden in rasantem Tempo entwickelt, und die Markteintrittsbarrieren sind mitunter niedrig. Die entscheidende Herausforderung für Investoren wird darin bestehen, die Start-up-Teams zu finden, die nicht nur ein erfolgreiches Produkt entwickeln, sondern auch in der Lage sein werden, sich mit der Zeit einen Wettbewerbsvorteil zu verschaffen.
- Es gibt bereits eine Vielzahl von KI-Lösungen auf dem Markt, die einen erheblichen Mehrwert bieten, insbesondere in den Bereichen der Radiologie und der Pathologie. Neben dem medizinischen und gesellschaftlichen Nutzen dieser Lösungen ist jedoch auch das Verständnis und die Einschätzung, wie dieser Wert optimal genutzt werden kann, von entscheidender Bedeutung, wenn langfristige Erfolgsmodelle entwickelt werden sollen. Dies erfordert eine gezielte Auswahl der richtigen Technologien im richtigen Entwicklungszyklus sowie eine sorgfältige Bewertung des Reifegrades der Unternehmen.
Wir befinden uns in einer spannenden Zeit des Fortschritts und der Möglichkeiten im Gesundheitswesen. Wir sind sehr optimistisch, dass Tech-Bio die Biotechnologie vorantreiben kann, aber es ist auch wichtig, ihre Grenzen zu verstehen und die richtigen Strategien aus Investorensicht zu erkennen.
1 “Designing drugs with computers” Marcia Bartusak, Discover, August 1981
2 The protein or molecule in the body that is involved in a disease process and that a drug can interact with
3 Kwon, S., Bae, H., Jo, J. et al. Comprehensive ensemble in QSAR prediction for drug discovery. BMC Bioinformatics 20, 521 (2019) https://doi.org/10.1186/s12859-019-3135-4
4 “AI in small molecule drug discovery: black box or crystal ball” Alacrita 2023
5 “The Coming Wave” Mustafa Suleyman 2023
7 Moleküle, die sich spezifisch an ein Protein binden, um bestimmte Funktionen auszuführen, z. B. seine Aktivität zu aktivieren, zu hemmen oder zu verändern. Proteinliganden
können Arzneimittel sein, die so konzipiert sind, dass sie mit einem bestimmten menschlichen Protein (Target) interagieren.
8 Chemische Verbindung, die sich in frühen Tests als vielversprechend für die Entwicklung eines neuen Arzneimittels erwiesen hat. Der Leitwirkstoff hat wünschenswerte
Eigenschaften, die das Zielmolekül in einer Weise beeinflussen, die für die Behandlung einer Krankheit geeignet sein könnte. Sie muss jedoch weiter modifiziert und getestet
werden, um sicherzustellen, dass sie wirksam und sicher ist und zu einem für Patienten geeigneten Medikament entwickelt werden kann.
9 “Artificial intelligence in drug discovery: what is realistic, what are illusions? Part 1: Ways to make an impact, and why we are not there yet.”
10 “Generative AI in the pharmaceutical industry: moving from hype to reality” McKinsey and co; January 2024
11 “Biopharma report: Q4 2023” Pitchbook
WICHTIGE HINWEISE:
Dieses Dokument wurde von Altamar CAM Partners S.L. (zusammen mit seinen Tochtergesellschaften „AltamarCAM„) ausschließlich zu Informations- und Illustrationszwecken sowie als allgemeiner Marktkommentar erstellt und ist ausschließlich für die Verwendung durch den Empfänger bestimmt. Wenn Sie dieses Dokument nicht von AltamarCAM erhalten haben, sollten Sie es nicht lesen, verwenden, kopieren oder weitergeben. Die hierin enthaltenen Informationen spiegeln die Ansichten von AltamarCAM zum Zeitpunkt dieses Dokuments wider, die sich jederzeit und ohne Vorankündigung ändern können, ohne dass eine Verpflichtung zur Aktualisierung besteht oder sichergestellt wird, dass Sie über etwaige Aktualisierungen informiert werden. Dieses Dokument basiert auf Quellen, die als zuverlässig angesehen werden, und wurde mit größtmöglicher Sorgfalt erstellt, um zu vermeiden, dass es unklar, zweideutig oder irreführend ist. Es wird jedoch keine Zusicherung oder Garantie hinsichtlich seiner Wahrhaftigkeit, Genauigkeit oder Vollständigkeit gegeben, und Sie sollten nicht davon ausgehen, dass dies gegeben ist. AltamarCAM übernimmt keine Verantwortung für die in diesem Dokument enthaltenen Informationen. Dieses Dokument kann Prognosen, Erwartungen, Schätzungen, Meinungen oder subjektive Einschätzungen enthalten, die auch als solche zu verstehen sind und niemals als Zusicherung oder Garantie für gegenwärtige oder zukünftige Ergebnisse, Erträge oder Gewinne. Soweit dieses Dokument Aussagen über die künftige Entwicklung enthält, sind diese Aussagen zukunftsgerichtet und unterliegen einer Reihe von Risiken und Unwägbarkeiten. Bei diesem Dokument handelt es sich lediglich um einen allgemeinen Marktkommentar, der in keiner Weise als eine unterliegende Beratung, Anlageangebot, Aufforderung oder Empfehlung zu verstehen ist. Alternative Anlagen können hochgradig illiquide sein, sind spekulativ und eignen sich möglicherweise nicht für alle Anleger. Investitionen in alternative Anlagen sind nur für erfahrene und versierte Anleger gedacht, die bereit sind, die mit einer solchen Anlage verbundenen hohen wirtschaftlichen Risiken zu tragen. Potenzielle Anleger einer alternativen Anlage sollten den jeweiligen Fondsprospekt und die Bestimmungen lesen, in denen die spezifischen Risiken und Überlegungen im Zusammenhang mit einer bestimmten alternativen Anlage beschrieben sind. Die Anleger sollten die potenziellen Risiken sorgfältig prüfen und abwägen, bevor sie investieren. Keine natürliche oder juristische Person, die dieses Dokument erhält, sollte eine Investitionsentscheidung treffen, ohne zuvor eine rechtliche, steuerliche und finanzielle Beratung auf einer spezifizierten Basis erhalten zu haben. Weder AltamarCAM noch seine Konzerngesellschaften oder deren jeweilige Anteilseigner, Direktoren, Manager, Angestellte oder Berater übernehmen irgendeine Verantwortung für die Integrität und Richtigkeit der hierin enthaltenen Informationen oder für die Entscheidungen, die die Adressaten dieses Dokuments auf der Grundlage dieses Dokuments oder der hierin enthaltenen Informationen treffen könnten. Dieses Dokument ist streng vertraulich und darf ohne die vorherige schriftliche Zustimmung von AltamarCAM weder ganz noch teilweise vervielfältigt oder in irgendeiner anderen Weise veröffentlicht werden.



